
临床试验研究需要根据ICH GCP指导原则开展,其中重要的一点是需要保障受试者权益、安全和福祉。同时临床试验研究的方案需要通过科学地设计、开展及分析以达到设定的目标,也应当被适当地报告。所以与方案设计产生违背可能会影响受试者的权益或数据的完整性。但在实际临床研究中,方案违背始终无法避免,但影响程度不尽相同。
1、方案违背Protocol deviation(PD)的定义
既往临床研究中会用到方案违反(Protocol violation), 表示与试验方案的明显背离,并与重要方案违背(Major protocol deviation)有时可相互替代。
为了避免术语上的混淆,2012年发布的ICH E3 Q&A(R1)对方案违背做了正式的定义:“任何与试验方案设计或制定的流程的变化,差异或者背离”。
同时还要注意以下几点:
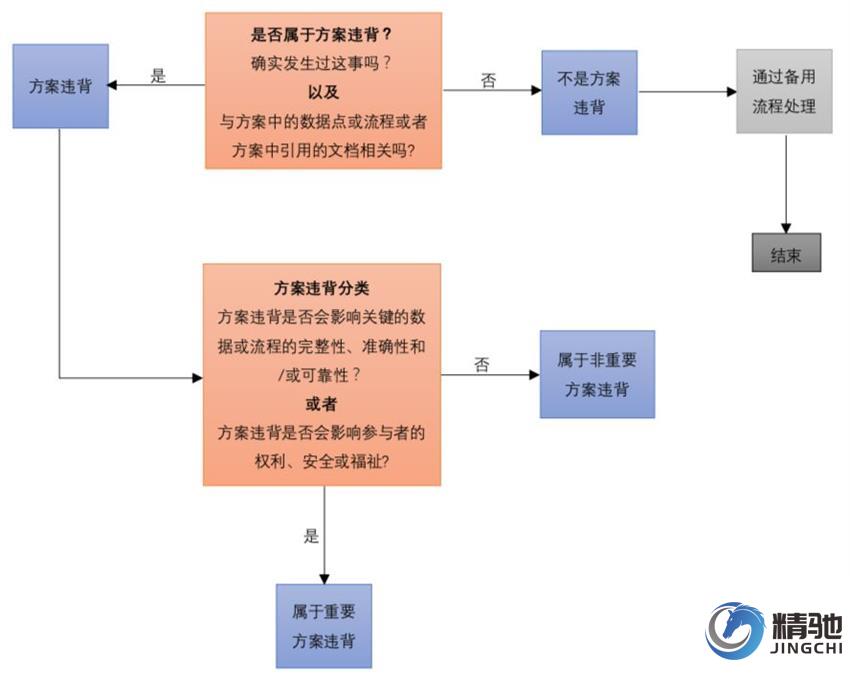
1)有事件发生;
2)事件与方案或与方案相关的文件(如实验室手册)有关
3)该事件与出现故障、责任或者环境无关——以确保客观的判定方法(如,样本在前往中心化验室途中破裂,受试者拒绝再次化验)
同时还引入了重要方案违背的概念“可能严重影响试验数据完整性、准确度和/或可靠性的,或者显著影响受试者权利、安全或健康的方案违背”。
例如,纳入的受试者违反关键纳入标准,或未能采集主要终点所必需的数据,均可视为重要方案违背,因为它们可能会影响试验的科学价值。
2、判定PD流程
判定方案违背的过程主要可以分为两步:一是识别是否为方案违背;二是进行分类,确定重要和非重要方案违背。下图方案违背决策树有助于完成这一过程。
3、GCP依从性≠方案违背
因为临床研究是按照ICH GCP的指导原则开展的,所以有些人认为所有GCP依从性问题都是方案违背,从而增加了方案违背的数量。因此提议GCP依从性问题不属于方案违背,除非是重要的方案违背,如:
受试者收到过期的试验药物
没有适当资格或未参加过培训的研究人员执行的关键或关键研究程序。
4、总结报告中PD的描述
在临床试验总结报告中应描述所有重要的方案违背,包括入组或排除标准、试验开展、患者管理或患者评估。因此在总结报告正文中,试验方案违背应该按各研究中心,并分为不同的类别进行适当概括,如:
即使不符合入选标准但仍参加了研究的患者;
在研究期间达到退出标准但未退出研究的患者;
接受错误治疗方案或使用不正确剂量的患者;
接受应排除的伴随疗法的患者。
参考文献
ICH-E3 STRUCTURE AND CONTENT OF CLINICAL STUDY REPORTS.
TransCelerate_ProtocolDeviation_ProcessGuide.